Молекулярные основы эволюции (белки, нуклеиновые
кислоты, первичный и вторичный генетический коды)Страница 1
БЕЛКИ, высокомолекулярные природные полимеры, построенные из остатков аминокислот, соединенных амидной (пептидной) связью —СО—NH—. Каждый белок. характеризуется специфической аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией). На долю белков приходится не менее 50% сухой массы орг. соединений животной клетки. Функционирование белков лежит в основе важнейших процессов жизнедеятельности организма. Обмен в-в (пищеварение, дыхание и др.), мышечное сокращение, нервная проводимость и жизнь клетки в целом неразрывно связаны с активностью ферментов. Основу костной и соединительной тканей, шерсти, роговых образований составляют структурные белки. Они же формируют остов клеточных органелл (митохондрий, мембран и др.). Расхождение хромосом при делении клетки, движение жгутиков, работа мышц животных и человека осуществляются по единому механизму при посредстве белков сократительной системы. Важную группу составляют регуляторные белки, контролирующие биосинтез белков и нуклеиновых кислот
По составу белки делят на простые, состоящие только из аминокислотных остатков, и сложные. Сложные могут включать ионы металла или пигмент. В соответствии с формой молекул белки подразделяют на глобулярные и фибриллярные. Молекулы первых свернуты в компактные глобулы сферической или эллипсоидной формы, молекулы вторых образуют длинные волокна (фибриллы) и высокоасимметричны. Большинство глобулярных белков, в отличие от фибриллярных, растворимы в воде.
Строение белковых молекул.
Практически все белки построены из 20![]() аминокислот, принадлежащих, за исключением глицина, к L-ряду. Аминокислоты соединены между собой пептидными связями, образованными карбоксильной и
аминокислот, принадлежащих, за исключением глицина, к L-ряду. Аминокислоты соединены между собой пептидными связями, образованными карбоксильной и![]() аминогруппами соседних аминокислотных остатков (см. формулу I):
аминогруппами соседних аминокислотных остатков (см. формулу I):
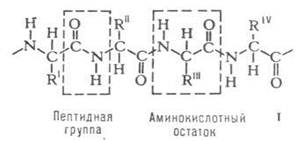
(формула I)
Белковая молекула может состоять из одной или нескольких цепей, содержащих от 50 до нескольких сотен (иногда – более тысячи) аминокислотных остатков. Молекулы, содержащие менее 50 остатков, часто относят к пептидам.
Различают четыре уровня организации белковых молекул. Последовательность аминокислотных остатков в полипептидной цепи наз. первичной структурой. Все белки различаются по первичной структуре; потенциально возможное их число практически неограниченно. Термин "вторичная структура" относится к типу укладки полипептидных цепей. Наиболее часто встречающиеся типы – правая![]() спираль и
спираль и![]() структура. Под третичной структурой белков понимают расположение его полипептидной цепи в пространстве. Термин "четвертичная структура" относится к макромолекулам, в состав которых входит несколько полипептидных цепей, не связанных между собой ковалентно. Такая структура отражает способ объединения и расположения этих субъединиц в пространстве.
структура. Под третичной структурой белков понимают расположение его полипептидной цепи в пространстве. Термин "четвертичная структура" относится к макромолекулам, в состав которых входит несколько полипептидных цепей, не связанных между собой ковалентно. Такая структура отражает способ объединения и расположения этих субъединиц в пространстве.
Свойства.
Физико-химические свойства белков определяются их высокомолекулярной природой, компактностью укладки полипептидных цепей и взаимным расположением остатков аминокислот
Синтез.
Биосинтез белков происходит в результате трансляции в субклеточных частицах – рибосомах, представляющих собой сложный рибонуклеопротеидный комплекс. Информация о первичной структуре белка "хранится" в соответствующих генах – участках ДНК – в виде последовательности нуклеотидов. В процессе транскрипции эта информация с помощью фермента – ДНК – зависимой РНК – полимеразы – передается на матричную рибонуклеиновую кислоту, которая, соединяясь с рибосомой, служит матрицей для синтеза белка. Выходящие из рибосомы синтезированные полипептидные цепи, самопроизвольно сворачиваясь, принимают присущую данному белку конформацию, а также подвергаются модификации благодаря реакциям различных функциональных групп аминокислотных остатков и расщеплению пептидных связей.
Методы исследования. Метод
определения активности карбоксипептидазы Н
Активность КП Н определяли модифицированным методом Fricker L.D. и Snyder S.H. [148].
Для определения активности фермента к 150 мкл (в случае опытной пробы) или 140 мкл (в случае контрольной пробы) 50 мМ натрий-ацетатного буфера, содержащего 50 мМ NaCl (рН 5,6), добавляли 50 мкл гомогената ткани. В контрольные пробы, кроме того, добавл ...
Исследование ассимиляции ЭДТА штамма LPM-4 в
процессе культивирования с добавлением ЭДТА
Описание: Культуру выращивали на среде с ЭДТА (вариант 1 – контроль). Ассимиляция ЭДТА происходила достаточно быстро и закончилась на четвертые сутки роста (рис. 3.2.1.1, приложение 9), при этом наблюдался рост биомассы до 0,190 г/л. На четвертые сутки роста культуры добавили ЭДТА (вариант 2). При этом культура потребила ЭДТА очень быст ...
Основные особенности и внутрисистемные связи живых систем
При всем своем многоплановом разнообразии живые системы имеют некоторые, хотя и немногочисленные, но неотъемлемые общие особенности, определяемые фундаментальными общими свойствами живого. Таких особенностей три: 1) наличие собственной программы развития системы, развертываемой на основе активно регулируемых информационных взаимосвязей ...
