Реакционная способность веществ, анализ и синтез. Реакционная способность веществ
РЕАКЦИОННАЯ СПОСОБНОСТЬ, характеристика относительной хим. активности молекул, атомов, ионов, радикалов. Для количественной оценки рассматривают реакционные серии, т.е. ряды однотипных реакций, проводимых в одинаковых условиях, например: (стандартная реакция)
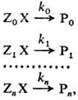
где Х – общая группа атомов, которая претерпевает изменения в данной реакции (реакционный центр), Z0, Zl, ., Zn – неизменяющиеся молекулярные фрагменты, Р0, Р1, ., Рn – продукты реакции. Отношения констант скоростей k1/k0, ., kn/k0 количественно характеризуют реакционную способность. В ряду реагентов ZiX
(i = 0, 1, ., п). В правильно составленной реакции серии изменение механизма реакции должно быть исключено, т. е. константы скорости должны характеризовать одну и ту же элементарную реакцию.
Типичные реакционные серии.
Простейшая ситуация возникает при анализе изомерного состава продуктов реакции. В реакции замещения в ароматическом ряду в зависимости от заместителя R образуются те или иные изомеры, например, при нитровании:
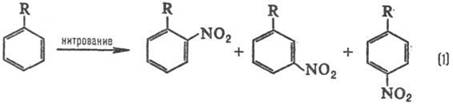
Электронодонорные заместители [R=СН3, ОСН3, N(CH3)2] стимулируют образование орто- и пара-продуктов, а электроноакцепторные (R = СООН, SO3H, NO2) – мета-продуктов, причем в первом случае реакция идет легче, чем с незамещенным бензолом (R = Н), а во втором – труднее. Эти закономерности называются правилами ориентации в ароматическом ряду. Стереохимическая направленность перипиклической реакций определяется Вудворда-Хофмаина правилами, например:
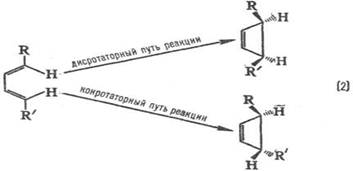
При дисротаторном пути реакции заместители R и R' в продукте будут расположены по одну сторону плоскости цикла, при конротаторном пути – по разные стороны. Эксперимент показывает, что термическая циклизация производных бутадиена происходит по конротаторному пути, а фотохимическая циклизация – по дисротаторному пути.
В примерах (1) и (2) нет необходимости в количественных кинетических измерениях, реакционная способность определяется по относительному выходу изомеров. Пример широкой реакционной серии – реакции радикального присоединения по двойной связи:
![]()
Реакционная способность характеризуется отношением константы скорости k к константе скорости k0 реакции с этиленом (R, R' = Н) (см. табл.). Аналогичные кинетические измерения сделаны для реакций присоединения метильного радикала к ароматическим молекулам и для реакций присоединения др. радикалов.

Квантовохимическая теория реакционной способности.
Современная теоретическая химия позволяет непосредственно рассчитать константы скорости только для несложных хим. систем. В теории реакционной способности качественной закономерности могут быть выявлены для объектов любой сложности. При этом используют различные подходы. При эмпирическом подходе классифицируют влияние заместителей по нескольким типам (эффекты сопряжения, полярные, пространственные и др.) и применяют корреляционные соотношения. Традиционный квантовохимический подход основан на активированного комплекса теории; при этом предполагается, что для всех реакций, составляющих реакционную серию, остается примерно постоянным множитель А в Аррениуса уравнении для константы скорости k=Aexp(-E./RT). Поэтому характеристикой реакционной способности служит энергия активации реакции E., которая практически совпадает с высотой потенциального барьера на поверхности потенциальной энергии (ППЭ).
Советскому ученому Н.Н. Семенову предстояло открыть разветвленные цепные реакции
. Теория разветвленных цепных реакций дала начало новому направлению исследований - химической физике, дисциплине, промежуточной между физикой и химией.
В химии были также открыты колебательные реакции, получившие название «химических часов». Основа колебательной реакции – наличие двух типов молекул, способных превращаться друг в друга. Назовем один из них А (красные молекулы), другой – В (синие). Мы привыкли думать, что химическая реакция – это хаотические, происходящие наобум столкновения частиц. По этой логике взаимные превращения А и В должны приводить к усредненному цвету раствора со случайными вспышками красного и синего. Но когда условия далеки от равновесных, происходит совершенно иное: раствор в целом становится красным, потом синим, потом снова красным. Получается, будто молекулы как бы устанавливают связь между собой на больших, макроскопических расстояниях через большие, макроскопические отрезки времени. Появляется нечто похожее на сигнал, по которому все А или все В реагируют разом . Такое поведение традиционно приписывалось только живому - теперь же ясно, что оно возможно и у систем сравнительно простых, неживых.
Церебролизин и терапия ишемического инсульта
Ишемический инсульт представляет наиболее тяжелую форму ишемической патологии головного мозга и служит одной из главных причин нетрудоспособности и высокой смертности населения.
Последовательность развивающихся процессов при ишемическом инсульте включает:
1. Энергетический дефицит в клетках мозга, занимающий первые минуты и первую пол ...
Характеристики сред
Консервирующие среды
предупреждают отмирание патогенов и подавляют рост сапрофитов. Наибольшее применение нашли глицериновая смесь (среда Тига), гипертонический раствор, глицериновый консервант с LiCl2, раствор цитрата натрия и дезоксихолата натрия (среда Бенгсанга-Эллиота).
Среды обогащения
(например, среда Китта-Тароцци, селенитов ...
Модель биосферных кризисов
Кризис интерпретируется как обращение тенденций, характеризующих нормальный эволюционный процесс. Сопоставление последовательности событий на геоисторических рубежах, признанных кризисными (пермь-триас, мел-палеоген), позволяет выявить общие закономерности, которые проявляются в смене стабильного геомагнитного поля знакопеременным, обши ...
