Гемагглютинин вируса гриппа – наиболее полно охарактеризован ная гликопротеиновая структура
Этот белок связан с вирусной мембраной с помощью короткого трансмембранного домена на С-конце. Он синтезируется как единая полипептидная цепь, но при созревании претерпевает протеолитическое расщепление с образованием двух полипептидов, HAi и НА2, связанных дисульфидной связью. Участок, отвечающий за слияние, локализован на N‑конце НА2. Он соответствует N‑концу G‑белка вируса везикулярного стоматита.
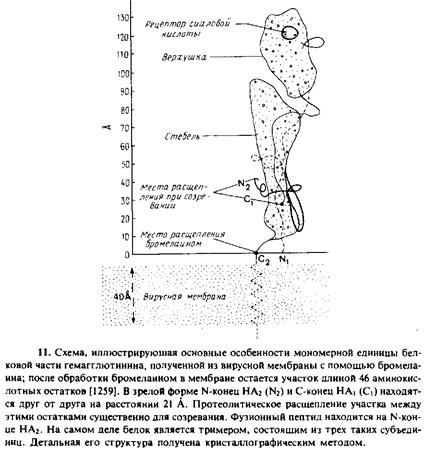
С помощью рентгеновской кристаллографии была определена трехмерная структура водорастворимого домена гемагглютинина. Этот домен получают с помощью расщепления бромелаином. Он представляет собой трнмер из – субъединиц, напоминает по форме стержень и выступает из мембраны на 135 А. Каждая субъединица имеет а-спиральный «стебель» с глобулярной «верхушкой», которая содержит рецепторыый участок для сиалогликосоединений.
Гидрофобный фузионный пептид спрятан между субъединицами тримера и находится на расстоянии 30 А от поверхности мембраны. Как известно, при низких рН третичная и четвертичная структуры белка необратимо изменяются. При рН 5,0 белок приобретает способность связывать липиды и детергенты и самоагретируется, что позволяет думать об экспонировании гидрофобного домена. По-видимому, это коррелирует с экспонированием фузионного пептида, который теперь может связаться с мембраной-мишенью, способствуя сближению обеих мембран и облегчая их слияние. Были выделены и получены in vitro мутанты с другими рН-оптнмумом и фузноинымн свойствами. Это подтверждает важность контактирования субъединиц при рН-зависимом конформационном изменении структуры белка и роль фузионного пептида. Гемагглютинин ацилирован жирными кислотами, которые, по-видимому, усиливают фузионную активность.
Суммируя все сказанное выше, можно сделать вывод, что, хотя физико-химические механизмы слияния мембран до конца не установлены, очевидно, что специфическое слияние мембран внутри клетки может осуществляться с помощью некоего белокзависимого процесса. Для этого должно произойти специфическое межмембранное взаимодействие, обеспечивающее прикрепление мембран друг к другу, и должен присутствовать мембранный белок, который при необходимости обеспечивает слияние. Для изучения свойств таких белков можно использовать белки, образующие шиловидные структуры вирусных частиц. Но могут применяться и другие модельные системы. Вероятно, семейство таких белков участвует в слиянии мембран как при экзоцитозе, так и при эндоцитозе.
Биосфера и человек
Современный человек сформировался около 30-40 тыс. лет назад. С этого времени в эволюции биосферы стал действовать новый фактор –антропогенный. Первая созданная человеком культура – палеолит (каменный век)продолжалась примерно 20-30- тыс. лет; она совпала с длительным период омоледенения. Экономической основой жизни человеческого общест ...
Эффекты лейкотриенов
Спазмогенное действие (на ГМК стенок сосудов, а также бронхиол и кишечника) не вызывает тахифилаксии, в связи с чем длительность эффекта лей-котриенов весьма велика. Спазм микрососудов, особенно артериол, в очаге воспаления приводит к развитию ишемии.
Положительный хемотаксический эффект по отношению к фагоцитам.
Повышение проницаемос ...
Новообразование. Пример и схема
Новообразование –это разновидность комплементарности. Характеризуется тем, что в F1появл нов признак, которого не было у родителей и которые не встречались в природе. 9:3:3:1 (F2). А – розовитый, а – не влияет,В – гороховодный, в – не влияет, аавв – простой, А?В? – ореховидный (новообразование). 1) Аавв*ааВВ=АаВв; 2) АаВв*ААВв=9А?В?, 3А ...
