Трехмерная структура иммуноглобулиновСтраница 1
В каждой из легких цепей молекул антител существуют две внутрицепочечные дисульфидные связи, число таких связей в тяжелых цепях различно. Каждый из внутрицепочечных дисульфидных мостиков образует петлю из 55—70 а.о.
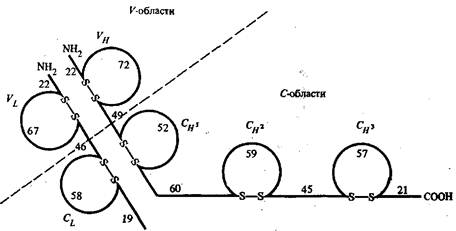
Рис. 1 - Схема расположения внутрицепочечных дисульфидных связей в легких и тяжелых цепях молекулы IgG человека
На рис. 1 приведено схематическое изображение расположения дисульфидных связей вдоль тяжелых и легких цепей IgG человека с указанием среднего числа аминокислотных остатков в составе каждой из петель. По данным рентгеноструктурного анализа, участки пептидных цепей вблизи петли образуют глобулу, в которую включается примерно 110 а. о. Такие глобулы получили название доменов. Н2-концевые домены тяжелых и легких цепей относятся к вариабельным частям, а СООН-концевые домены — к константным частям. Было установлено, что аминокислотные последовательности константных доменов из тяжелых цепей в пределах одного класса являются весьма сходными между собой.
Н2-концевой домен тяжелой цепи обозначают как Ун, а три последующих в константной области тяжелой цепи — как Сн1. Сн2 и СнЗ. А и у тяжелые цепи содержат по 3 константных домена, обозначаемых как Са1, Са2, Са3 для IgA и Cvl, Су2, С£ для IgG, а более длинные ц- и е-цепи — по четыре.
Рентгеноструктурный анализ, выполненный для нескольких белков — димера Я-цепей, двух димеров F-областей Fab-фрагментов IgG и IgA, а также Fc-фрагмента IgG, позволил установить пространственное расположение отдельных участков полипептидных цепей и доменов. Домены L- и Н-цепей представляют собой полусферы, соединенные вдоль одной цепи линейными полипептидиыми отрезками, доступными растворителю и действию протеолитических ферментов. Их основным структурным элементом являются два почти параллельных слоя, один из которых состоит из четырех линейных антипараллельных отрезков цепи, второй — из трех. В состав этих р-слоев входит около 60% антипараллельные сегменты fxl — fx4 и fyl — fy3 обра-ауют два практически параллельных слоя Р-складчатой структуры. Между ними лежат сегменты, образующие изгибы цепи, спирали н т.п.; V- н С-домены отличаются частью сегментов; V-домен имеет добавочную петлю Е; черный прямоугольник соответствует внутрицепочечной дисульфидной связи всех аминокислотных остатков области. Боковые заместители гидрофобных аминокислот образуют плотно упакованное ядро между р-слоями. Дисульфидная связь между р-слоями, являющаяся существенным элементом жесткости структуры доменов, находится в самом гидрофобном ядре и поэтому в водных растворах недоступна для восстанавливающих агентов.
Участков с а-спиральной конформацией в структуре доменов практически не содержится. По сравнению с С-доменами К-обла-сти несколько длиннее и содержат дополнительную петлю Е. В К-областях образующие ядро аминокислотные остатки с гидрофобными боковыми заместителями, а также остатки в изгибах полипептидной цепи, обеспечивающие ее необходимый поворот, являются консервативными или полуинвариантными. Гипервариабельные остатки располагаются на изгибах цепи таким образом, что оказываются пространственно сближенными.
Взаимодействие между Н-цепями в Fab-фрагменте обеспечивается множественными контактами между парами доменов Уъ и. Vn, Cl и Сн1. При ассоциации'Cl и Сн1 домены обращены друг к другу четырехцепочечными р-слоями и взаимодействуют вдоль обширной зоны.свободной от растворителя. В контактах, имеющих в основном гидрофобный характер, участвует около 30 а. о. Наоборот, Vi, и Ун-домены ориентированы друг к другу трехце-почечными р-слоями. Основную роль в стабилизации образующейся структуры играют взаимодействия между консервативными и полуинвариантными аминокислотами с гидрофобными боковыми заместителями. Гипервариабельные участки Vl, и Ун-областей сближены и образуют доступную растворителю относительно плоскую область связывания антигена.
В Fc-фрагменте lgG Сн2-домены тяжелых цепей ориентированы друг к другу трехцепочечными р-слоями, но непосредственно друг с другом не контактируют из-за ограничений, накладываемых наличием межцепочечных дисульфидных связей в Н2-конце Су2-доменов; между ними находятся углеводные фрагменты, ковалентно связанные с остатками Asn-297 каждой Ц-цепи. Они состоят главным образом из остатков глюкозы, глюкозамина, фруктозы и сиаловой кислоты. Содержание углеводов и состав существенно отличаются у разных классов. Их присоединение является постсинтетическим процессом и происходит упорядоченно во время внутриклеточного транспорта молекулы иммуноглобулина. До сих пор биологическая роль углеводного компонента не ясна.
Накопление аммония в процессе роста штамма LPM-4
Анализируя рис. 3.1.3., можно сделать вывод, что концентрация аммония в среде увеличивается по мере деградации ЭДТА, поскольку ионы аммония – продукты деградации ЭДТА. Во всех вариантах концентрация аммония достигает максимального значения и остается на постоянном уровне в течение нескольких дней. Снижение концентрации аммония при длите ...
Объекты и методы исследований. Объекты
исследований
Объектом исследований является почва, отобранная из различных экониш. Проба №1 – почва поля не посевного (Ахтубинский р-он), проба №2 – почва лесная (Ахтубинский р-он), проба №3 – почва садовая (парк АГТУ), проба №4 – почва луговая (луг заливной, Ахтубинский р-он), проба №5 – почва из грибницы шампиньона (Икряненский р-он). ...
Результаты и обсуждение. Определение зависимости
сигнала флуоресценции от концентрации ДНК
Готовили разведение матрицы с концентрациями 7, 3.5, 1.75, 0.875 и 0.219 нг. К растворам ДНК добавляли одинаковое количество красителя SYBRgreen согласно протоколу описанному в пункте 2.3.1. Образцы объемом 1 мкл помещали в лунки планшетов. Измерение и регистрацию флуоресцентного сигнала проводили с помощью описанной системы детекции и ...
