Механизм апоптозаСтраница 1
TNF-α и Fas-лиганд (CD178) запускают каскад биохимических реакций, финальным этапом которых является дефрагментация хромосом и гибель клетки. На поверхности клеток организма имеются специальные рецепторы для TNF-α, это TNF-RI (с молекулярной массой 55-60 кДа) и TNF-RII (с молекулярной массой 75-80 кДа), а для Fas-лиганда рецептор Fas / APO-1 (CD95).
TNF-R и Fas / APO-1(CD95) имеют гомологию в экстрацеллюлярных доменах, представленную в виде цистеин богатых доменов и гомологичную последовательность в интрацеллюлярной части рецептора.
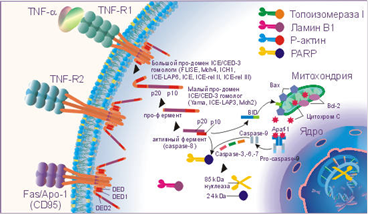
Рис.2. Апоптоз
Связывание TNF-α и Fas-лигандов с рецепторами апоптоза активирует интрацеллюлярные "домены смерти" (DED - death effector domain) этих рецепторов: DED, DED1 и DED2 и ряд посредников, включая церамиды, ras, SAPK / JNK, протеиновые тирозинкиназы, катепсин D и протеазы ICE / CED-3 семейства, которые каскадно проводят смертельный сигнал. Цистеиновые протеазы ICE / CED-3 семейства находятся в составе интрацеллюлярной части рецептора апоптоза в неактивной форме, они относятся к интерлейкин-lβ расщепляющим ферментам (ICE). Это семейство включает ряд различных типов протеаз, многие протеазы имеют несколько обозначений. Семейство цистеин-аспартат протеаз ещё называют каспазами.
Кроме семейства каспаз, в регуляции апоптоза принимает участие семейство Bcl-2 белков, в котором Bcl-2, Bcl-XL, Ced-9, Bcl-w, и Mcl-1 белки ингибируют апоптоз, а Bcl-2 гомологи (BH) 1-3, Bax подобный белок, Bak, Bok, и состоящие только из BH3 региона, Bad подобный белок, Bid, Bik, Bim, и Hrk выполняют проапоптозную функцию.
Активация DED, DED1 и DED2 вызывает каскадную перестройку и активацию протеаз ICE / CED-3 семейства. Первым этапом является превращение не активной про-каспазы-8 в активную каспазу-8. Каспаза-8 активирует каспазу-3 и Bid. Bid взаимодействуя с Bax способствует выходу из митохондрий цитохрома C, который активизирует каспазу-9. В свою очередь активная каспаза-9 приводит к появлению активных каспаз-3, - 6, - 7. В свою очередь активные ICE начинают взаимодействовать с рядом внутриклеточных субстратов: поли-(АДФ-рибозо) полимеразой (PARP), участвующей в репарации ДНК и модификации активности некоторых ядерных белков, ламином В1, топоизомеразой I и Р-актином. Все члены семейства ICE / CED-3 протеаз содержат каталитический остаток цистеина и расщепляют субстраты после аспарагиновой кислоты. Специфическое расщепление PARP, ламина В1, топоизомеразы I и Р-актина под действием ICE-подобных протеаз на большие и малые фрагменты приводит клетку к гибели, так как большие фрагменты этих субстратов и являются активными нуклеазами, которые разрезают хромосомы на фрагменты. Например, PARP расщепляется CPP32 / Yama на два фрагмента 85 и 24 кДа, из которых апоптоз-специфическим является фрагмент 85 кДа. Активация протеаз ICE / CED-3 семейства может происходить и под действием фосфолипидов, например, церамидов, которые способны активировать CPP32 / Yama.
Свободный сфингозин образуемый из церамидов в результате его гидролиза церамидазой так же активирует ICE-подобные протеазы и ускоряет апоптоз.
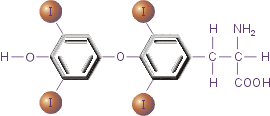
Рис.3. Тироксин
Важная роль в осуществлении апоптоза принадлежит тироксину (Т4).
Он регулирует функционирование протеиновой тирозинкиназы, важного элемента реализации сигнала смерти. При недостатке этого гормона щитовидной железы происходит подавление апоптоза.
IL-lβ блокирует апоптоз. ICE-подобные протеазы взаимодействуют с IL-lβ, а не с PARP, ламином В1, топоизомеразой I и Р-актином. В результате чего не происходит образования активных нуклеаз, и клетка избегает апоптоза.
Промеры черепа маньчжурского зайца
Скелет головы, или череп – является вместилищем головного мозга, органов слуха, зрения и обоняния, образует стенки ротовой и носовой полостей. Кости черепа преимущественно пластинчатые, многие из них пневматизированы – имеют пазухи (синусы) – заполненные воздухом. Это облегчает массу черепа, сохраняя обширные площади прикрепления мышц. ...
Предложения производству
Свободненский район – некогда один из самых лесистых районов Амурской области на глазах меняет свой облик. Уже на протяжении нескольких лет в районе ведутся бесконтрольные, сплошные рубки хвойных пород деревьев. Пожары, вызванные по вине человека, опустошают территории, заставляют зверей мигрировать к северу. Гари и вырубки постепенно з ...
Исследование ассимиляции ЭДТА штамма LPM-4 в
процессе культивирования с добавлением ЭДТА
Описание: Культуру выращивали на среде с ЭДТА (вариант 1 – контроль). Ассимиляция ЭДТА происходила достаточно быстро и закончилась на четвертые сутки роста (рис. 3.2.1.1, приложение 9), при этом наблюдался рост биомассы до 0,190 г/л. На четвертые сутки роста культуры добавили ЭДТА (вариант 2). При этом культура потребила ЭДТА очень быст ...
