Фазовое разделение
Для того чтобы жидкости смешивались, необходимо выполнение условия AG < 0. Но этого условия недостаточно для полного смешения жидкостей при любых концентрациях. Изменение свободной энергии при смешении, отнесенное к одному молю, определяется выражением
![]()
На рис. 3 представлены зависимости изменения свободной энергии при смешении) от мольной доли компонента А для разных значений параметра ч. Верхняя кривая соответствует разделению на фазы при начальной мольной доле 0.5. При этом образуются две фазы, концентрации которых отвечают точкам end.
Уравнение предсказывает, что разделение смеси на фазы происходит всегда прежде всего при условии jca = *в· Разделению смеси на фазы отвечает выполнение условия![]()
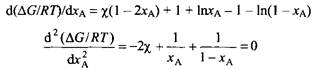
Рис. 2. Вода и диоксан ведут себя как несмешивающиеся жидкости, ацетон и хлороформ, напротив, смешиваются между собой
Из уравнения следует, что ч = 2 прихд=*в = 0.5, т. е. разделение смеси на фазы будет происходить при ч > 2. Температура, при которой начинается фазовое разделение, называется критической температурой:
![]()
Теория Брэгга-Вильямса отражает основы физики фазового разделения простых двухкомпонентных систем. Однако известны смеси двух жидкостей, которые полностью смешиваются при низких температурах, но разделяются на фазы при повышении температуры. На рис. 4 показаны различные случаи фазового поведения смесей. При повышенных температурах все системы неизбежно обнаруживают верхнюю критическую точку. Это соответствует замкнутой области смешения.
Считается, что нижняя критическая точка связана с влиянием температуры на изменение взаимодействий в смеси Aw. Но эти представления выходят за рамки модели Брэгга-Вильямса и не вносят ничего нового в понимание физического смысла явления. Для систем полиэтиленоксид-вода нижняя критическая точка, возможно, появляется вследствие индуцированных температурой структурных изменений оксиэтиленовых групп. Другими словами, для таких систем важную роль играют внутренние степени свободы, что не рассматривает модель Брэгга-Вильямса.
Полезно рассмотреть смешение воды и гидрофобных молекул, например углеводородов. Взаимодействие вода-вода отрицательно и существенно по величине, тогда как взаимодействия вода-углеводород и углеводород-углеводород по сравнению с ww слабые и их можно считать нулевыми. Тогда эффективное парное взаимодействие записывается следующим образом:
![]()
Параметр ч для такой системы при комнатной температуре будет иметь значение, близкое к 5. Таким образом, теория Брэгга-Вильямса предсказывает несмешиваемость масла и воды.
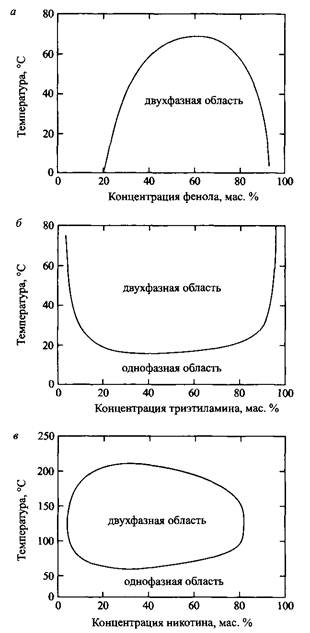
Рис. 4. Фазовые диаграммы смесей с верхними и нижними критическими точками: а — фенол-вода; б — триэтиламин-вода; в — никотин-вода
Морфологические проявления апоптоза
Апоптоз имеет свои отличительные морфологические признаки, как на светооптическом, так и на ультраструктурном уровне. При окраске гематоксилином и эозином апоптоз определяется в единичных клетках или небольших группах клеток. Апоптотические клетки выглядят как округлые или овальные скопления интенсивно эозинофильной цитоплазмы с плотным ...
Энергия и питательные
вещества
Животные нуждаются в пище, в результате переваривания которой они получают определенные специфические питательные вещества и витамины для роста и восстановления тканей, а также для борьбы с паразитами и болезнетворными организмами.
Клетки тела получают энергию главным образом в форме глюкозы, растворенной во внеклеточной жидкости. В пр ...
Воздействия на бронхи, трахею и гладкие мышцы
Простагландины серии F вызывают сокращение, а простагландины серии Е раслабление мышц бронхов и трахеи у животных различных видов, в том числе у человека. Как PGE1 так и PGE2 являются сильными бронходилятаторами (средствами, расширяющими просвет бронхов и бронхиол) при применении их в аэрозолях как людьми, так и животными, страдающими б ...
