Аффинная хроматографияСтраница 1
АФФИННАЯ ХРОМАТОГРАФИЯ (от лат. affinis - родственный) (биоспецифич. хроматография, хроматография по сродству), метод очистки и разделения белков, основанный на их избират. взаимод. с лигандом, ковалентно связанным с инертным носителем. В кач-ве лигандов используют соед., взаимод. к-рых с разделяемыми в-вами основано на биол. ф-ции последних. Так, при разделении ферментов (для чего преим. и применяется А. х) лигандами служат их субстраты, ингибиторы или коферменты. Главная особенность, к-рая обусловливает высокую эффективность А. х., состоит в том, что разделение основано на различии не физ. - хим. признаков молекулы (заряда, формы и размера), а специфич. функциональных св-в, отличающих данный фермент от множества др. биополимеров.
Неподвижная фаза в А. х. представляет собой специально получаемый сорбент, построенный обычно по схеме: носитель - соединяющее звено ("ножка") - специфич. лиганд. Носителем служит чаще всего сефарозапроизводное агарозы, имеющее поперечные сшивки. Присоединение к ней лиганда или "ножки", содержащих, как правило, аминогруппу, осуществляется после активации сефарозы бромцианом:
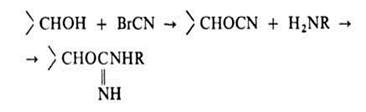
Содержание лиганда колеблется от 0,1 до 10 мкмоль на 1 г влажного сорбента. Сефароза, однако, малоустойчива к действию ряда хим. в-в и микроорганизмов.
Более стабильны макропористые неорг. носители (кремнезем, стекло) и орг. полимеры. Если лиганд присоединяется непосредственно к носителю, эффективность специфич. взаимод. с ферментом заметно снижается вследствие пространств. затруднений. "Ножка", как правило, устраняет стерич. препятствия, отдаляя лиганд от носителя. Как и носитель, она должна быть инертной и не влиять на процессы в ходе А. х., чего, однако, не всегда удается достигнуть. Напр., присоединение "ножки" по приведенной выше р-ции приводит к образованию катионной группировки изомочевины, и сорбент приобретает св-ва анионита. В кач-ве "ножки" используют обычно ди - и полиамины,![]() аминокислоты, пептиды, олигосахариды.
аминокислоты, пептиды, олигосахариды.
Лигандами могут служить субстраты (напр., крахмал или гликоген при разделении амилаз), однако их превращ. в ходе А. х., катализируемое разделяемым ферментом, постоянно изменяет св-ва сорбента. Поэтому, как правило, применяют аналоги субстратов, устойчивые к дальнейшему превращ., т.е. ингибиторы ферментов. Так, для выделения протеиназ используют не расщепляемые ими пептиды D-аминокислот. Эффективны прир. ингибиторы ферментов, напр. пепстатин - ингибитор аспартильных протеиназ. Иногда применяют лиганды, связывающие большие группы родственных ферментов (в частности, киназы и дегидрогеназы). Примеры таких "группоспецифич." лигандов-антрахиноновые красители, аналоги никотинамидадениндину-клеотида.
Известны лиганды (напр., производные фенилборной к-ты), имитирующие при взаимод. с ферментом структуру переходного комплекса с субстратом. Такие лиганды эффективны при выделении сериновых гидролаз.
Разделение в А. х. обычно проводят на хроматографич. колонках; иногда разделяемую смесь помещают в сосуд с сорбентом и выдерживают до полного связывания исследуемого компонента. Затем сорбент (в колонке или сосуде) промывают буферным р-ром для удаления несвязавшихся в-в, после чего десорбируют исследуемый компонент.д.есорбция (элюция) последнего обычно достигается повышением ионной силы, изменением рН буферного р-ра или добавлением в него орг. р-рителя, что ослабляет взаимод. лиганд - фермент. Более избирательна десорбция р-ром лиганда.
Помимо ферментов, методом А. х. можно выделять также токсины, рецепторы, ингибиторы, транспортные белки и др. биологически активные в-ва. Высокой избирательностью отличается т. наз. иммуносорбция, при к-рой в кач-ве лиганда используют антитела, обладающие специфичностью к выделяемым белкам; особенно эффективны моноклональные антитела.
Для разделения белков применяется также ряд др. аналогичных методов.Т. наз. ковалентная хроматография основана на избират. образовании и последующем расщеплении ковалентных связей между выделяемым в-вом и носителем, напр. между белком с SH-группами и ртуть-орг. производными агарозы.
Применяется также лигандообменная хроматография, при к-рой ферменты связываются через функциональный ион металла с комплексоном, иммобилизованным на носителе.
Получила распространение гидрофобная хроматография, при к-рой сорбент (напр., фенилсефароза), содержащий гидрофобные группировки, вкрапленные в гидрофильную матрицу, взаимодействует с гидрофобными участками, содержащимися на пов-сти белков. Нередко при этом наблюдаются также ионообменные взаимод., как, напр., при использовании в качестве сорбента алкиламиносефароз. Избират. выделение гликопротеинов обеспечивают иммобилизованные на носителях лектины - белки, специфически взаимодействующие с концевыми моносахаридными звеньями углеводных цепей.
Реабсорбция
Отфильтрованная жидкость течет по извитым канальцам. Капилляры из клубочка расходятся, образуя свободную сеть вокруг своих канальцев. Они оборачиваются вокруг канальца и соприкасаются с ним во многих местах.
По мере продвижения вниз, в сторону мозгового вещества почки, кровь капилляров реабсорбирует (обратно всасывает) ценные вещества ...
Выводы
В данной работе выполнены поставленные задачи по изучению белки обыкновенной в Свободненском районе Амурской области. Изучены морфологические и биологические особенности белки обыкновенной. Проведен анализ полученных данных.
Белка обыкновенная Свободненского района Амурской области отличается от особей этого же региона (по описанию в л ...
Основные понятия «элементарность», «простое-сложное», «деление».
Утверждение «система состоит из элементов»
всегда означало, что эта система представляет собой объект, состоящий из частей, меньших по величине или по массе, но сохраняющих внутри этой системы определенную индивидуальность, самостоятельность (конечно, ограниченную взаимодействием этих частей в рамках включающей их большей системы ...
