Антигенсвязывающие центры антителСтраница 1
Согласно рентгеноструктурным исследованиям комплексов Fab-фрагментов с антигенами связывание антигена происходит в доступной растворителю щели активного центра, образованной вариабельными доменами в N-концевой части легкой и тяжелой цепей. Длина щели антител варьирует от 0,4 до 3,4 нм, а средние размеры области связывания для полимерных антигенов различной природы составляют нм. С антигеном частично контактируют гипервариабельные участки Н- и L-це-пей, расположенные в местах изгибов полипептидной цепи, а также некоторые из аминокислотных остатков, более глубоких внутренних областей цепи. Особую роль в построении анти-генсвязывающего центра антител играет третий гипервариабельный участок Н-цепи, включающий от 1 до 20 а. о. Длина этого участка и контактирующего с ним первого гипервариабельного участка L-цепи во многом определяют размеры активных центров антител.
Способностью связывать антигены с той же эффективностью, что и нативные молекулы антител, обладают Fab- и Р2-фраг-менты иммуноглобулинов. Изолированные Н- и L-цепи имеют весьма низкое сродство к антигену, однако способность к специфическому узнаванию соответствующих антигенов у них сохраняется.
Во взаимодействии с антигеном участвует большое количество аминокислотных остатков обеих цепей молекулы антител, хотя, как правило, большая функциональная нагрузка приходится на Н-цепи.
Основным принципом организации антигенсвязывающих центров иммуноглобулинов является полицентровая структура. Малые антигенные детерминанты связываются на ограниченном участке активного центра, комплементарном данной детерминанте. Большие детерминанты могут занимать практически всю область связывания.
Убедительные доказательства существования пространственно разделенных участков связывания антигена были получены для белка миеломы мыши IgA МОРС 460, конкурентно взаимодействующего с 2,4-динитрофенолом и 2-метил-1,4-нафтохиноном:
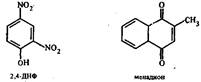
В антигенсвязывающем центре антител расположена сульфгидрильная группа, модификация которой приводит к потере иммуноглобулином способности связывания с менадионом, но никак не сказывается на эффективности взаимодействия с ДНФ. Антиген-связывающие свойства белка меняются после его частичной денатурации в растворе гуанидингидрохлорида и последующей ренатурации. С использованием флуоресцентных зондов было определено расстояние между подцентрами связывания менадиона и ДНФ, составившее 1,2—1,4 нм. Этот результат был подтвержден в экспериментах по сорбции IgA на носителях, содержащих связанные через «ножки» различной длины ДНФ и менадион.
С помощью рентгеноструктурного анализа комплекса миеломного белка IgGl человека с оксипроизводным витамина Кь состоящего из нафтохиноновой группировки и гидрофобной фитильной цепи, установлено, что молекула антигена локализована в полости, образованной вариабельными областями легкой и тяжелой цепей. В ней можно выделить два подцентра связывания отдельных частей молекулы KiOH. В подцентр связывания нафтохиноновой части входят аминокислотные остатки Туг-90, Gly-29, Asn-30 L-цепи, пептидная связь и боковой заместитель Cys-104 Н-цепи. Менадион, представляющий собой часть молекулы KiOH без фитильного хвоста, а также орцеин и уридин взаимодействуют с IgG именно в этом подцентре. Фитильная цепь KiOH, изгибаясь, контактирует с пептидной связью между остатками 29 и 30, а также Ser-93 и Leu-94 L-цепи и константным Тгр-54 Н-цепи.
В пользу полицентровой организации антигенсвязывающего центра свидетельствуют данные по рентгеноструктурному анализу димеров Я-цепей белка Бенс-Джонса Мс, характеризующихся наличием, по крайней мере, трех участков связывания. По своей структуре антигенсвязывающий центр представляет коническую впадину глубиной 1,7 нм с диаметром у поверхности 1,5 нм, а у основания 0,6 нм и полости на дне размером 0,8X1,0 нм. Два участка находятся на стенках конической впадины, а третий — на дне полости. В первом участке связываются ДНФ-лиганды, е-дан-силлизии, колхицин, 1,10-фенантролин. Во втором центре связываются также ДНФ-лиганды, метадои, морфин, кофеин, теофиллин. Бис лизин своими динитрофеиильными кольцами одновременно взаимодействует с первым и вторым участками, что свидетельствует о наличии в них общих структур. Третий центр связывает менадион, производные пиримидина, фенилртуть и нитрофе-нилфосфохолин.
Активность основных карбоксипептидаз in vitro при действии психолептиков
Для выяснения механизма действия психолептиков на активность основных карбоксипептидаз в отделах мозга и органах самцов крыс in vivo было исследовано влияние данных препаратов in vitro (таблицы 13-15).
Исходя из полученных данных, можно сделать вывод, что ни один из препаратов не влияет на активность исследуемых ферментов. Другими слов ...
Пищеварение в желудке
Многочисленные железы слизистой оболочки желудка вырабатывают желудочный сок. Основным ферментом его является пепсин, расщепляющий сложные молекулы белка на более простые молекулы аминокислот. Пищеварение в желудке происходит только при температуре тела 35—37 °С и при наличии в желудочном соке соляной кислоты, повышающей активность ферм ...
Связывание на фильтрах
Является стандартно используемой методикой для определения РНК-белковых взаимодействий и оценки константы связывания. Принцип данного метода основан на способности нитроцеллюлозных фильтров удерживать белки, а также связанные РНК, пока несвязанные РНК проходят через фильтр. Несмотря на свою концептуальную простоту, метод всё же не являе ...
